Alat Kesehatan Domestik (MFDS)
Tujuan
Tujuan dari ‘Domestic Medical Device Notification, Certification or Approval’ adalah untuk mendorong efisiensi pengelolaan alat kesehatan dan berkontribusi terhadap peningkatan kesehatan masyarakat dengan menetapkan hal-hal mengenai manufaktur, impor, perbaikan, dan penjualan.
(No. 13698 “UU Alat Kesehatan”, No. 2015-114 “Peraturan Peninjauan Laporan Persetujuan Alat Kesehatan, Dll.”)
Ringkasan
Sesuai dengan ‘Domestic Medical Device Notification, Certification or Approval’, seseorang yang bermaksud memproduksi, mengimpor, memperbaiki, menjual, atau menyewakan alat kesehatan harus melaporkan, mengesahkan, dan memperoleh Persetujuan atas alat kesehatan yang bersangkutan untuk menjual alat kesehatan di Korea.
Target
Handler Alat Kesehatan
“Handler alat kesehatan” mengacu pada salah satu pihak berikut yang menangani alat kesehatan sebagai bagian dari bisnisnya dan telah memperoleh izin atau mengajukan laporan berdasarkan Undang-Undang Alat Kesehatan;
- Produsen Peralatan Medis
- Importir Alat Kesehatan
- Reparasi Peralatan Medis
- Penjual Alat Kesehatan
- Penyewa Alat Kesehatan
Dokumentasi yang Diperlukan
Notifikasi Manufaktur (impor) alat kesehatan golongan I
- Pemberitahuan (Lampiran No. 7 Formulir Peraturan Pemberlakuan UU Alat Kesehatan)
- Tujuan penggunaan, dll. (Terlampir tabel 1 Peraturan Klasifikasi Produk Alat Kesehatan dan Kelas Berdasarkan Produk)
- Seluruh proses pengiriman: Dokumen yang membuktikan kondisi penerima barang (dokumen yang dapat membuktikan apakah dia adalah orang yang dapat dipercaya untuk seluruh proses pembuatan)
- Untuk notifikasi kategori barang: Saat notifikasi manufaktur (impor), tandai di kolom “Items” pada notifikasi tersebut.
※ Untuk Alat Kesehatan yang pada dasarnya tidak setara dalam struktur, prinsip, kinerja, tujuan penggunaan, dan metode penggunaan dengan perangkat yang telah disetujui atau diberitahukan di antara Kelas I, anda harus mengajukan Persetujuan ke Kementerian Makanan dan Obat-obatan Keamanan.
Pemberitahuan pembuatan (impor) alat kesehatan golongan I modifikasi
- Pemberitahuan (Lampiran No. 7 Formulir Peraturan Pemberlakuan UU Alat Kesehatan)
- Seluruh proses pengiriman: Dokumen yang membuktikan kondisi penerima barang (dokumen yang dapat membuktikan apakah dia adalah orang yang dapat dipercaya untuk seluruh proses pembuatan)
- Modifikasi umum: Jika terdapat perubahan pada produk yang dinotifikasi untuk manufaktur (impor), lampirkan ‘Minor Kor_Changes Report’ sebagai ‘Kor_Changes’ dan serahkan kepada kepala Badan Pengawas Obat dan Makanan daerah yang berwenang dalam waktu 30 hari atau terhitung sejak hari terakhir bulan sebelum tanggal Persetujuan awal atau pemberitahuan sampai dengan hari terakhir bulan itu setiap tahunnya
※ Jika pendaftaran diubah di situs pengaduan elektronik alat kesehatan, perubahan tersebut dianggap telah diberitahukan
- Dalam hal terjadi modifikasi karena pengalihan atau akuisisi: Dianggap sebagai laporan sesekali mengenai perubahan kecil
- Saat memproses laporan perubahan kecil akibat pengalihan atau akuisisi, nama produsen dan perubahan nama produk diproses bersama dan penyerahan perjanjian pengalihan atau akuisisi (asli) diperlukan.
Produk setara alat kesehatan Kelas II
- Permohonan sertifikasi manufaktur (impor)
- Persetujuan alat Kesehatan (Lampiran No. 3/5 formulir Peraturan Pemberlakuan UU Alat Kesehatan)
- Material yang setara dengan dokumen teknis produk berlisensi
- Salinan sertifikat kepatuhan terhadap Standar Manufaktur Alat Kesehatan dan Pengendalian Mutu (GMP) untuk barang atau kelompok barang serupa
※ Sesuai dengan Pasal 6 (4) “Undang-Undang Alat Kesehatan”, seseorang yang mencoba untuk mendapatkan izin produksi atau sertifikasi manufaktur atau memberi tahu manufaktur setelah tanggal 29 Januari 2016 harus mempersiapkan fasilitas dan sistem manufaktur serta kendali mutu yang diperlukan terlebih dahulu. untuk mengajukan atau memberitahukan lisensi atau sertifikasi.
- Manufaktur sertifikat penjualan, panduan pengguna
- Sertifikat Manufaktur(notarisasi)
Diakui produk setara substansial alat kesehatan Kelas II
- Permohonan sertifikasi manufaktur (impor)
Persetujuan alat Kesehatan (Lampiran No. 3/5 formulir Peraturan Pemberlakuan UU Alat Kesehatan) - Laporan pengujian dan pemeriksaan yang diterbitkan oleh lembaga pengujian dan inspeksi yang ditunjuk oleh Menteri Keamanan Pangan dan Obat
※ Laporan pengujian yang membuktikan bahwa produk tersebut cocok untuk produk yang diumumkan setara
※ Laporan pengujian yang dikeluarkan oleh lembaga pengujian dan inspeksi yang ditunjuk oleh Menteri Keamanan Pangan dan Obat
- Salinan sertifikat kepatuhan terhadap Standar Manufaktur Alat Kesehatan dan Pengendalian Mutu (GMP) untuk barang atau kelompok barang serupa
※ Sesuai dengan Pasal 6 (4) “Undang-Undang Alat Kesehatan”, seseorang yang mencoba untuk mendapatkan izin produksi atau sertifikasi manufaktur atau melaporkan produksi setelah tanggal 29 Januari 2016 harus mempersiapkan fasilitas dan sistem manufaktur serta kendali mutu yang diperlukan terlebih dahulu. untuk mengajukan atau melaporkan lisensi atau sertifikasi.
- Dokumen yang membuktikan kondisi penerima barang (terbatas pada seluruh proses pengiriman)
- Tabel perbandingan item-item yang pada dasarnya setara
Alat kesehatan kelas III dan IV
- Permohonan Persetujuan Pembuatan Alat Kesehatan (Impor)
(Lampiran Nomor 3 Formulir Peraturan Pemberlakuan Undang-Undang Alat Kesehatan) - Pemberitahuan hasil pemeriksaan seperti dokumen teknis, dokumen teknis, dan data uji klinis
※ Pemberitahuan hasil pemeriksaan seperti dokumen teknis, dll. harus dilakukan dalam waktu dua tahun sejak tanggal penerbitan
- Dokumen yang membuktikan kondisi penerima barang (terbatas pada seluruh proses pengiriman)
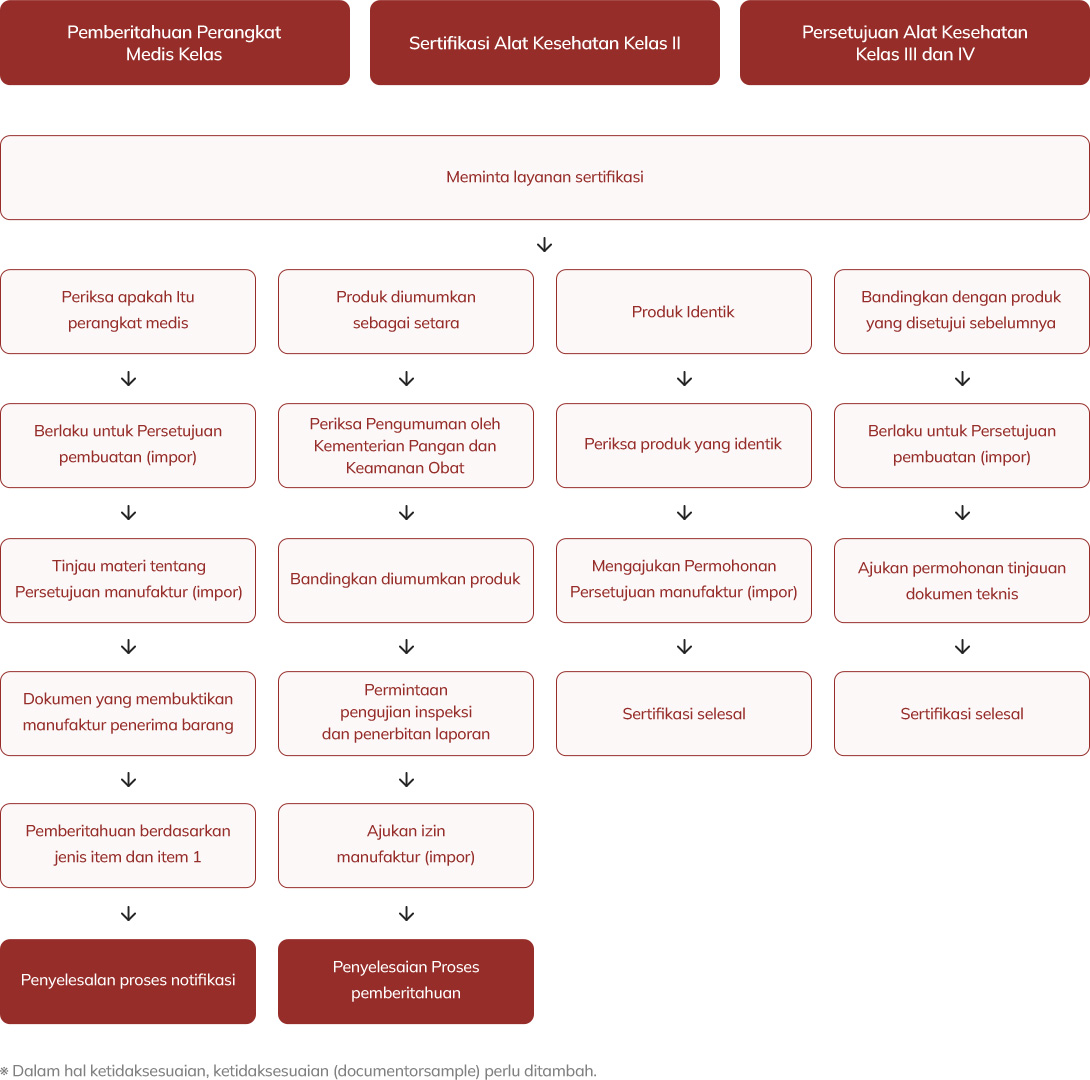
Proses
Catatan
Pasal 51 (Hukuman)
Seseorang yang termasuk dalam salah satu dari berikut ini akan dihukum penjara tidak lebih dari lima tahun atau denda tidak melebihi 50 juta won:
- Seseorang yang telah memperoleh Persetujuan atau sertifikasi atau membuat laporan berdasarkan Pasal 6 Ayat 1·2 atau Pasal 15 Ayat 1·2 dengan cara penipuan atau cara ilegal lainnya;
- Seseorang yang melanggar Pasal 26 Ayat 1;
- Seseorang yang telah menerima perpanjangan berdasarkan Ayat 3 Pasal 49 dengan cara penipuan atau cara ilegal lainnya;




